继商务部、海关总署和国家市场监督管理总局紧急发布 2020年第12号公告后, 宣布进一步升级对包括非医用口罩在内防疫物资出口质量监管措施,大家迫切的想知道黑名单的企业有哪些,今天官方公告终于出炉了.
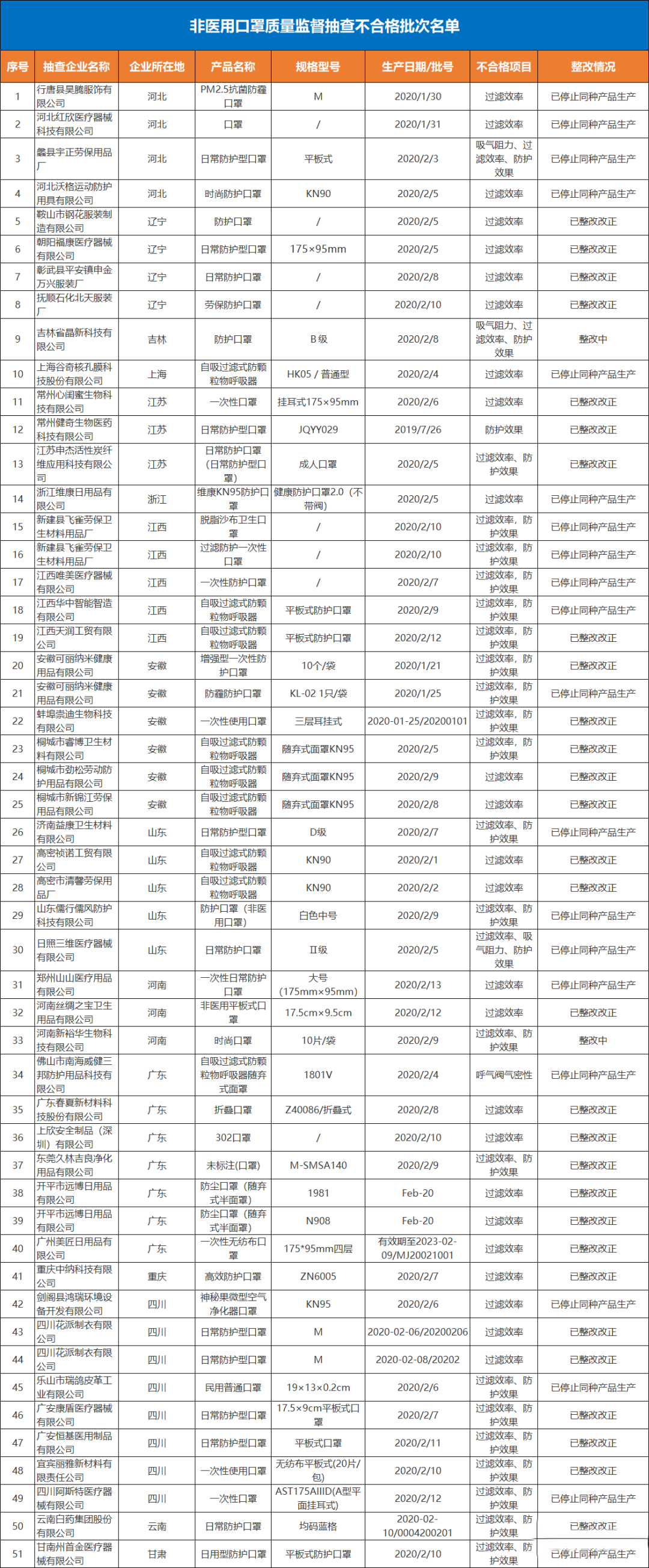
非医用口罩质量监督抽查不合格批次名单查询
企业申请产品CE标志流程如下:
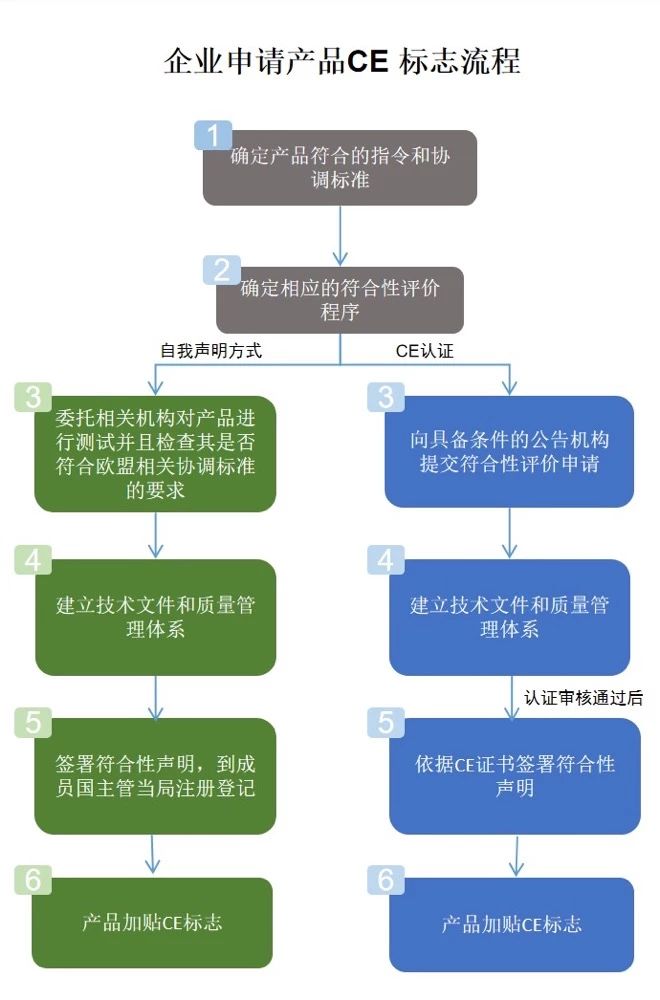
 确定产品符合的指令和协调标准
确定产品符合的指令和协调标准
指令是欧盟为协调各成员国现行法律的不一致而制定的法律要求,覆盖了不同范围的产品。欧盟协调标准是用于指导产品满足指令基本要求的详细技术文件。以口罩为例,根据预期用途的不同,分为医用口罩和个人防护口罩两种,分别归属医疗器械条例EU2017/745(MDR)或医疗器械指令93/42/EEC(MDD)和个人防护设备条例EU2016/425(PPE)进行管理。
防疫医疗物资适用的技术法规和标准要求查询
医疗物资国内外质量安全标准可登录“海关总署网站—总署概况—商品检验司—政策法规”栏目查询(不定期更新)。
确定相应的符合性评价程序
按照欧盟规定,不同产品采用不同的评价方式加贴CE标志,主要有两种方式:绝大部分产品是制造商采取自我符合性声明方式,就可以加贴CE标志;部分风险相对更高的产品需要经过欧盟授权的第三方机构,即公告机构(Notified Body)进行符合性评定后,方可加贴CE标志。
开展符合性评价
对于不需要公告机构参与的,由制造商委托相关机构对产品进行测试并且检查其是否符合欧盟相关协调标准的要求。对于需要公告机构参与的,应向具备条件的公告机构提交符合性评价申请。
建立技术文件和质量管理体系
1:技术文件要求:技术文件是欧盟医疗器械指令中很重要的一个事项,它的目的是要求企业准备充份的技术资料和证明,供主管机关抽查,或发生诉讼纠纷时使用。
2:制造商质量管理系要求:
质量管理体系可以参照协调性标准ISO 13485:2016进行。需要说明的是:质量管理体系需要参照ISO13485:2016来运行或者审核,但对于公告机构符合性评定来说,ISO13485认证证书并不是必须或者强制的,但多数的制造商都会选择取得ISO 13485认证证书,这样可以提高客户对制造商能满足法规要求及产品质量保证的信心。
指定欧盟授权代表
对于欧盟境外的制造商(如中国的制造商),需要在欧盟境内授权一个欧盟代表,代替制造商在欧盟进行相关活动,比如在主管当局进行自我声明产品的登记和不良事件的报告等。制造商需要和授权欧盟代表签订协议,并规定各自承担的职责。
签署符合性声明并加贴CE标志
采用自我符合性声明方式的:
在确保产品符合欧盟相关法规要求后,由制造商签署符合性声明,到成员国主管当局注册登记之后,即可在产品加贴CE标志进入欧盟销售。
经公告机构符合性评定方式的:
制造商依据CE证书签署符合性声明,产品加贴CE标志后就可以进入欧盟市场。CE标志必须按照其标准图样,清楚且永久地贴在产品或其铭牌上。如果公告机构参与了产品的认证,则CE标志必须带有公告机构的公告号。